H2so4 Termasuk Elektrolit – Mengapa dia tidak bisa berada di bawah pohon saat hujan? Mengapa larutan garam menghantarkan listrik sedangkan larutan gula tidak?
Misalnya ada larutan gula, larutan garam, larutan teh. Tapi bagaimana dengan air kopi? Kami menganggapnya sebagai solusi ?????
H2so4 Termasuk Elektrolit
4 Campuran terdiri dari dua komponen utama, yaitu zat terlarut dan pelarut. Jika dari contoh diatas zat terlarutnya adalah gula, garam, teh dan kopi, sedangkan pelarutnya adalah air. Suatu zat dikatakan larutan jika campuran antara zat terlarut dan pelarutnya homogen. Artinya tidak ada batas antar komponen, sehingga tidak dapat dibedakan antara pelarut (air) dan zat terlarut (gula, kopi atau teh).
Asam Berikut Yang Jika Dilarutkan Kedalam Air Bersifat Elektrolit Lemah Adalah…
5 Suatu larutan dapat dikatakan larutan elektrolit jika zat tersebut mampu menghantarkan listrik. Mengapa elektrolit dapat menghantarkan listrik?
6 Suatu zat dapat menghantarkan listrik karena memiliki ion-ion yang bergerak bebas dalam larutan. Ion-ion ini nantinya akan menjadi konduktor. Semakin banyak ion yang dihasilkan, semakin baik larutan tersebut menghantarkan listrik.
Larutan asam (zat yang melepaskan ion H+ jika dilarutkan dalam air), contohnya: Asam klorida : HCl Asam klorida : HF Asam sulfat : H2SO4 Asam asetat/cuka : CH3COOH Asam sianat : HCN Asam nitrat : HNO3 Asam fosfat : H3
Natrium hidroksida : NaOH Kalsium hidroksida : Ca(OH)2 Litium hidroksida : LiOH Kalium hidroksida : KOH Barium hidroksida : Ba(OH)2 Magnesium hidroksida : Mg(OH)2 Aluminium hidroksida : Al(OH)3 Besi(II) hidroksida : Fe(OH)2 Besi( III) hidroksida: Fe(OH)3 Amonium hidroksida: NH4OH
Modul Larutan Elektrolit Dan Non Elektrolit Desain Inovasi
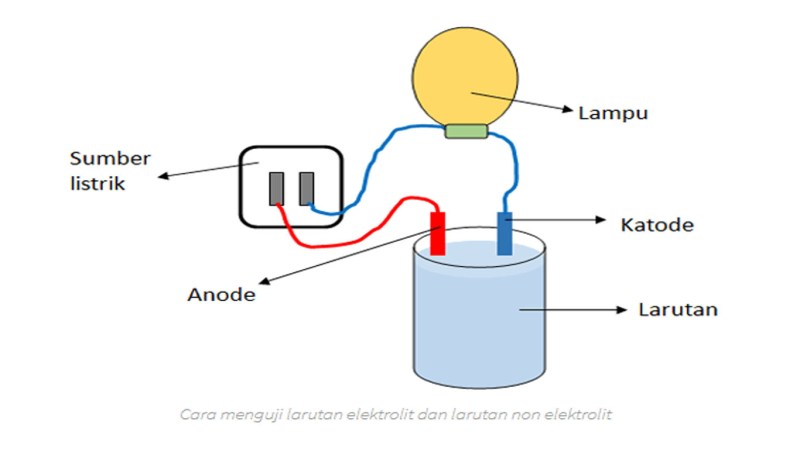
13 ELEKTROLIT KUAT . . . Elektrolit kuat, sifat-sifatnya adalah sebagai berikut: Menghasilkan banyak ion Sedikit atau tidak ada molekul netral dalam larutan Terionisasi penuh, atau sebagian besar terionisasi penuh Jika dilakukan uji konduktivitas listrik: dihasilkan banyak gelembung gas, lampu menyala Konduktor listrik yang baik Tingkat ionisasi = 1, atau mendekati 1
Elektrolit lemah, sifat-sifatnya adalah sebagai berikut: Menghasilkan lebih banyak ion. derajat ionisasi mendekati 0
17 Bukan elektrolit. . . Larutan tanpa elektrolit memiliki sifat sebagai berikut: Tidak menghasilkan ion Semua berupa molekul netral dalam larutan Tidak terionisasi Jika dilakukan uji konduktivitas listrik: tidak menghasilkan gelembung dan lampu tidak menyala
1. Senyawa ionik (senyawa yang terbentuk melalui ikatan ion), contohnya: NaCl, CaCl2, AlCl3, MgF2, LiF (sebagian besar berasal dari garam) 2. Senyawa kovalen polar (senyawa melalui ikatan kovalen yang bersifat polar/memiliki perbedaan elektronegativitas antar atom) Contohnya adalah: HCl, NaOH, H2SO4, H3PO4, HNO3, Ba(OH)2 (berasal dari asam dan basa)
Pulau Jawa] Asam Sulfat / H2so4 1 Kg
SOLUSI SIFAT DAN PENGAMATAN CONTOH SENYAWA UNTUK REAKSI IONISASI Elektrolit kuat – terionisasi sempurna – menghantarkan arus listrik – cahaya terang – mengandung gelembung gas NaCl, HCl, NaOH, H2SO4 dan KCl NaCl Na Cl-Na ++ SO4- KCl K+ + Cl- Elektrolit lemah – terionisasi sebagian – menghantarkan arus listrik – lampu menyala redup – muncul gelembung gas CH3COOH, NH4OH, HCN dan Al(OH)3 CH3COOH H+ + CH3COO- HCN H+ Al(OH)3 Al3+ + 3OH- Bukan elektrolit – tidak terionisasi – tidak menghantarkan arus – cahaya tidak menyala – tidak ada gelembung gas C6H12O6, C12H22O11, CO(NH2)2 and C2H5OH C6H12O6 C12H22HH2O11 CO(N)
Agar situs web ini berfungsi, kami mencatat data pengguna dan membaginya dengan pemroses. Untuk menggunakan situs web ini, Anda harus menerima kebijakan privasi kami, termasuk kebijakan cookie kami. Larutan asam sulfat (H2SO4) 1 M memiliki konduktivitas yang lebih baik daripada asam sulfat (H2S) 1 M. Perbedaan ini timbul karena derajat ionisasi asam sulfat lebih besar daripada asam sulfida
Larutan elektrolit adalah zat yang dapat membentuk ion dalam suatu pelarut sehingga larutan tersebut dapat menghantarkan listrik. Ini karena larutan elektrolit terionisasi dalam pelarut.
Larutan tanpa elektrolit adalah zat yang tidak dapat membentuk ion dalam pelarutnya sehingga larutan tersebut tidak dapat menghantarkan arus listrik.
Diketahui Beberapa Senyawa Elektrolit Berikut.1) Kcl 2)
Larutan H2SO4 adalah larutan asam kuat yang terionisasi sempurna ketika dilarutkan dalam pelarut. Reaksi ionisasi larutan H2SO4 adalah
Karena larutan H2SO4 dapat terionisasi sempurna menjadi ion-ionnya, larutan H2SO4 merupakan larutan elektrolit kuat. Sehingga pada uji konduktivitas listrik akan menghasilkan nyala api yang kuat dan menghasilkan banyak gelembung gas pada elektroda. Ciri larutan elektrolit kuat adalah memiliki derajat ionisasi sama dengan 1 (α = 1).
Hal ini menyebabkan uji konduktivitas listrik menghasilkan cahaya redup dan beberapa gelembung gas. Oleh karena itu, larutan H2S merupakan larutan elektrolit lemah yang memiliki derajat ionisasi lebih besar dari 0 dan lebih kecil dari 1 (0 < α < 1).
Sebuah pertanyaan baru dalam kimia, persamaan reaksi kimianya adalah…..Al + H2 SO4 ➡️ Al2 (SO4)3 + H3 penggaris plastik membuat 50 getaran dalam 2 menit berapa frekuensi dan periode sumber daya terbarukan? sifat fisik atau kimia? Mengapa kita dapat merasakan denyut nadi saat selesai beraktivitas tolong jelaskan dengan benar kak SK DAN KD Standar Kompetensi Inti Memahami sifat-sifat larutan elektrolit dan non elektrolit Membedakan larutan elektrolit dan non elektrolit Mengidentifikasi larutan elektrolit dan non elektrolit elektrolit berdasarkan hasil percobaan Hal. : 2 Masukkan judul halaman yang ditautkan
X 5 Lar Elektrolit
TUJUAN PEMBELAJARAN 1. Siswa dapat membedakan larutan elektrolit dan non elektrolit 2. Siswa dapat memberikan contoh larutan yang termasuk larutan elektrolit dan non elektrolit 3. Siswa dapat membedakan elektrolit kuat dan elektrolit lemah berdasarkan data percobaan Hal.: 3 Lengkap dengan judul halaman terkait
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Larutan non-elektrolit adalah larutan yang tidak menghantarkan listrik. Berdasarkan daya hantar listriknya larutan elektrolit dibedakan menjadi: Elektrolit kuat Elektrolit lemah Hal.: 5 Masukkan judul halaman terkait
Pada larutan elektrolit, lampu yang digunakan terang dan gas muncul pada elektroda. Larutan ini disebut elektrolit kuat Hal.: 6 Isikan judul halaman yang ditautkan
Dalam larutan elektrolit, nyala lemah atau bahkan tidak menyala dan gas yang terbentuk relatif sedikit. Larutan ini disebut elektrolit lemah Hal.: 7 Isikan judul halaman yang bersangkutan
Larutan Asam Sulfat (h2so4) 1m Mempunyai Daya Hantar Yang Lebih Baik Daripada Asam Sulfida (h2s)
Larutan elektrolit kuat adalah larutan yang dapat menghantarkan listrik dengan baik, karena zat terlarut akan terdisosiasi sempurna (derajat ionisasi a = 1) menjadi ion. Larutan elektrolit lemah adalah larutan yang dapat menghantarkan listrik dengan buruk. karena zat terlarut sebagian akan berdisosiasi (a<<1) menjadi ion. Hal.: 8 Isi dengan judul halaman terkait
Asam kuat Contoh : HCl, HClO3, H2SO4, HNO3 dll. Basa kuat Contoh : NaOH, KOH, Ca(OH)2, Ba(OH)2 dll. Garam kuat Contoh : NaCl, K2CrO4, KI, Al2(SO4)3 Hal .: 9 Lengkapi dengan judul halaman terkait
Asam lemah Contoh : CH3COOH, HCN, H2CO3, H2S dst. Basa lemah Contoh : NH4, Ni(OH)2 dst. Garam Garam lemah Contoh : AgCl, CaCrO4, PbI2 dst. Hal.: 10 Isikan judul halaman yang ditautkan
Agar situs web ini berfungsi, kami mencatat data pengguna dan membaginya dengan pemroses. Untuk menggunakan situs web ini, Anda harus menerima kebijakan privasi kami, termasuk kebijakan cookie kami. Apakah Anda bertanya-tanya mengapa listrik dapat mengalir di air? Nah, fenomena ini merupakan salah satu fenomena yang berkaitan dengan contoh larutan elektrolit.
Najwa Gizka Angelina Kelompok 3
Atau mungkin Anda merasa saat rumah Anda kebanjiran, lampu atau listrik di rumah Anda justru terputus dari PLN? Lagi-lagi karena ini berkaitan dengan sifat larutan elektrolit dan non-elektrolit.
Ternyata banyak fenomena dalam kehidupan yang berkaitan dengan larutan elektrolit dan non-elektrolit. Tapi apa sebenarnya yang dimaksud dengan larutan elektrolit dan non-elektrolit?
Jika salah satu alasan mematikan listrik saat banjir adalah takut listrik mengalir di air, apakah semua jenis air atau larutan bisa benar-benar menghantarkan listrik? Bagaimana dengan air cuka? Air gula? Atau air asin?
Hingga saat ini, kami berpikir pasti bahwa semua jenis air adalah konduktor, tetapi pada tahun 2016, seperti yang diinformasikan oleh
Praktikum Larutan Elektrolit Dan Non Ele
Science Alert, berdasarkan penelitian yang dipimpin oleh Mark Johnson dari Universitas Yale, menyatakan bahwa air yang benar-benar murni tidak menghantarkan listrik, karena kurangnya elektron bebas.
Namun sebagian besar air yang terdapat di alam kita ini bercampur dengan berbagai jenis sedimen dan mineral yang kemudian mengionisasi molekul air dan memungkinkan terjadinya aliran listrik.Itulah sebabnya air atau H2O merupakan contoh larutan elektrolit lemah.
Pertama-tama, arti dari kata “larutan”, dimana larutan tidak sama dengan air, melainkan campuran yang homogen, terdiri dari dua zat atau lebih.
Yang dimaksud dengan larutan homogen adalah larutan tersebut memiliki komposisi yang seragam atau setiap bagian volume akan memiliki komposisi atau sifat yang sama.
Larutan Elektrolit & Non Elektrolit
Zat yang ada dalam jumlah lebih sedikit disebut zat terlarut atau zat terlarut dan zat yang ada dalam jumlah lebih banyak disebut pelarut.
Larutan sendiri memiliki banyak jenis, diantaranya adalah larutan elektrolit dan larutan non-elektrolit yang akan saya bahas lebih lanjut di bawah ini.
Anda dapat menjawab pertanyaan apa yang dimaksud dengan larutan elektrolit secara sederhana jika larutan elektrolit adalah larutan yang memiliki partikel berupa ion yang dapat menghantarkan listrik.
Dari penjelasan singkat di atas, mungkin Anda bertanya-tanya mengapa larutan elektrolit dapat menghantarkan listrik? Arus listrik dipanjangkan oleh larutan elektrolit dengan mekanisme apa?
Larutan H₂so₄ Di Dalam Air Akan Terionisasi Dengan Reaksi?
Berdasarkan proses pembentukan ion (ionisasi), larutan elektrolit dibedakan menjadi 2 macam, yaitu larutan elektrolit kuat dan larutan elektrolit lemah.
Karena sifat ini maka larutan yang paling baik dapat menghantarkan listrik adalah larutan yang termasuk dalam kelompok larutan elektrolit kuat.
Ciri-ciri larutan elektrolit kuat adalah terionisasi sempurna membentuk ion bebas ketika larut, dan tidak ada molekul
Elektrolit, minuman isotonik termasuk larutan elektrolit, msds h2so4, kapasitor elektrolit, n h2so4, harga h2so4 per liter, harga h2so4, h2so4, h2so4 merck, ch3cooh termasuk elektrolit karena, harga h2so4 merck, jual h2so4





Leave a Comment